介绍
垂体腺瘤是常见的良性颅内内分泌肿瘤。Marie于1886年首先描述肢端肥大症,1887年Minkowski论及肢端肥大症由垂体腺排列异常引起,1900年Benda认识到伴肢端肥大症的嗜酸性腺瘤并证明肿瘤是来自腺垂体细胞的真性肿瘤。
最新文章
症状
垂体腺瘤瘤细胞的倍增时间为100~700天,故肿瘤生长缓慢,这种生物学特征决定了垂体腺瘤一般起病潜隐,早期可无症状。有的肿瘤甚至自始至终没有症状,死后尸检始被发现。垂体腺瘤主要有颅内神经功能障碍及内分泌功能障碍两方面表现:
1.神经功能障碍垂体腺瘤引起的神经症状直接与肿瘤大小及其生长方向有关。一般无分泌功能腺瘤在确诊时往往肿瘤体积已较大,多向鞍上及鞍外生长,临床神经症状多较明显。分泌性腺瘤因早期产生内分泌亢进症状,确诊时大多体积较小,肿瘤多位于蝶鞍内或轻微向鞍上生长,临床不产生或仅有轻微的神经症状。
(1)头痛:约2/3无分泌性垂体腺瘤病人可有头痛,但不太严重。早期头痛是由于肿瘤向上生长时,牵拉由三叉神经第1支支配的鞍膈所引起。头痛位于双颞部、前额、鼻根部或眼球后部,呈间歇性发作。肿瘤穿破鞍膈后头痛可减轻或消失。晚期头痛可能由于肿瘤增大影响颅底硬膜、动脉环、大血管、大静脉窦等痛觉敏感组织所引起。如涉及由三叉神经或后组脑神经供应的硬脑膜,则头痛位于前头部或后枕部。肿瘤向第三脑室生长,阻塞室间孔引起颅内压增高,可引起弥漫性头痛。有时肿瘤内出血或肿瘤的囊肿破裂可引起急性剧烈头痛。GH腺瘤引起的头痛明显而顽固,大多为全头痛,原因除肿瘤向上生长牵拉鞍膈外,主要是因为整个颅骨及硬膜增生,牵拉刺激感觉神经所致。
(2)视神经受压症状:垂体腺瘤向上方生长可将鞍膈顶高或突破鞍膈向上压迫视神经交叉而产生视力、视野改变等。
①视野改变:视交叉与垂体的位置变异较大,故视野变化颇不一致。由于视网膜纤维及黄斑纤维在视交叉中的排列又有一定位置,因此产生视野缺损亦有一定顺序。肿瘤由鞍内向上生长可压迫视交叉的下方及后方,将视交叉推向前上方,甚至将视交叉竖起,此时首先受压迫的是位于交叉下方的视网膜内下象限的纤维,引起颞侧上象限视野缺损。肿瘤继续生长可累及视交叉中层的视网膜内上象限纤维,因而产生颞侧下象限视野缺损。此时即为双颞侧偏盲。有时因视网膜内上象限的纤维有一部分混杂在不交叉的纤维中,位于视交叉侧面,故在颞侧偏盲中可保留小片视野,称“颞侧小岛”。压迫及外侧的视网膜外上象限的纤维(不交叉),可产生鼻侧下象限的视野缺损。位于视交叉的最外侧的视网膜外下象限的纤维最不易受到压迫,所以鼻侧上象限的视野常得以保留直至最后受压后才丧失。
如肿瘤位于视交叉的后方,它可先累及位于视交叉后部的黄斑纤维,而出现中心视野暗点,称暗点型视野缺损。其发展顺序亦与周边视野相同,并逐渐与周边视野缺损相融合。早期病例如周边视野影响较轻时,应同时检查中心视野暗点,才不致误诊。如肿瘤向一侧生长,压迫视束,则临床可出现同向性偏盲,这种情况少见。少数视交叉前置者,肿瘤向鞍后上方生长,临床可无视野障碍。
必须注意,视野改变首先是有色视野缺损,其中红色视野缺损出现最早,故对早期病例,应用小试标或有色视标检查最易发现问题,从而得出早期诊断。一般情况下,视野改变与肿瘤大小是相平行的。但如果肿瘤发展很慢,即使肿瘤很大,由于视神经可以避让,可不出现视野变化;如肿瘤生长很快,常首先出现暗点。
②视力改变:视力的减退与视野缺损并不平行,两侧也不对称,常到晚期才出现,并可发展到失明。这主要是视神经原发性萎缩的结果。
③视盘改变:由于视神经受压及血循环障碍,大多数病人有视盘原发性萎缩,且多为双侧同时开始,但程度不等。少数可一侧先开始。萎缩多先由鼻侧开始。少数病例因有阻塞性脑积水、颅内压增高、视网膜静脉回流发生障碍,可出现视盘水肿。但如已发生视盘原发性萎缩者,即使再有颅高压,也不致产生视盘水肿。因为此时视神经周围的蛛网膜鞘已被闭合,阻止了视盘水肿的出现。少数病例肿瘤偏于一侧,可产生患侧视神经原发萎缩,对侧视盘水肿(Foster-Kennedy综合征)。
(3)邻近症状:肿瘤向鞍外生长压迫邻近结构而引起。
①向外侧发展:压迫或侵入海绵窦,可产生第Ⅲ、Ⅳ、Ⅵ对脑神经及三叉神经第1支的障碍,其中以动眼神经最常受累,引起一侧眼睑下垂、眼球运动障碍。肿瘤沿颈内动脉周围生长,可渐使该动脉管腔变狭或闭塞,而产生偏瘫、失语等。肿瘤长入三叉神经半月节囊中,可产生继发性三叉神经痛。长到颅中窝可影响颞叶,而有钩回发作,出现幻嗅、幻味、轻偏瘫、失语等症状。
②向前方发展:可压迫额叶而产生精神症状,如神志淡漠、欣快、智力锐减、健忘、大小便不能自理、癫痫、单侧或双侧嗅觉障碍等。
③向后方发展:可长入脚间窝,压迫大脑脚及动眼神经,引起一侧动眼神经麻痹,对侧轻偏瘫即Weber综合征等表现。甚?ahref="http://jck.39.net/jiancha/huaxue/bian/4e7e1.html"target="_blank"class=blue>量上蚝笱蛊鹊妓?芏??鹱枞?阅曰???/P>
④向上方生长:影响第三脑室,可产生下丘脑症状,如多饮、多尿、嗜睡和精神症状,如近事遗忘、虚构、幻觉、定向力差、迟钝,以及视盘水肿、昏迷等。
⑤向下方生长:可破坏鞍底长入蝶窦、鼻咽部,产生反复少量鼻出血、鼻塞及脑脊液鼻漏等。
⑥向外上生长:可长入内囊、基底节等处,产生偏瘫、感觉障碍等。
2.内分泌功能紊乱各型分泌性腺瘤可分泌过多的激素,早期即可产生不同的内分泌亢进症状。无分泌功能腺瘤可压迫及破坏腺垂体细胞,造成促激素减少及相应靶细胞功能减退,临床产生内分泌功能减退症状。少数内分泌性腺瘤病例在病程晚期亦可产生垂体功能减退。
(1)PRL腺瘤:多见于女性年轻者(20~30岁),男性病例约占15%。因PRL增高抑制下丘脑促性激素释放激素的分泌,使雌激素降低,LH、FSH分泌正常或降低。亦有认为高PRL血症影响正常雌激素的负反馈作用及黄体酮的合成。临床典型表现为闭经-溢乳-不孕三联征(称Forbes-Albright综合征),亦有少数不完全具备以上三联征者。PRL增高至60μg/L时可出现月经紊乱,如月经过少、延期,或有月经但不排卵、黄体酮不足、黄体期不显著等。随着PRL进一步增高,可出现闭经。闭经病例多同时伴有溢乳,但大多数挤压乳房时方流出少量乳汁;也有部分病人不伴有溢乳。其他尚可有性欲减退、流产、肥胖、面部阵发潮红等。在青春期患病者,可有发育期延迟、原发闭经。因雌激素可促进PRL细胞增生,故临床可见妊娠后发生PRL瘤。口服避孕药(特别是低雌激素活性者)与PRL瘤的发生无关。
男性高PRL血症者可致血睾酮生成及代谢障碍、血睾酮降低。精子生成障碍、数量减少、活力降低、形态异常。临床有阳痿、性功能减退、不育、睾丸缩小,少数可有毛发稀少、肥胖、乳房发育及溢乳(约占20%)等。
女性病人多能早期确诊,有2/3病例为鞍内微腺瘤(肿瘤直径
病因
(一)发病原因
目前认为垂体腺瘤来源于腺垂体细胞,如单激素细胞腺瘤如生长激素、泌乳素细胞腺瘤等来源于分泌相应激素的腺细胞,而对一些多激素来源的腺瘤还有争议。过去一直认为一种细胞只能分泌一种相应的激素,20世纪70年代Zimmemrman用PAP法研究5例正常人垂体组织证实,在同一种细胞内具有能与生长激素和泌乳素两种激素抗体结合的颗粒,说明两种激素可以同时在同一垂体细胞内产生。Midyley认为促卵泡素和黄体生成素可由同一种细胞分泌。Horvath报告了9例垂体泌乳素、生长激素细胞腺瘤。Kovacs也指出在非肿瘤情况下这种双激素分泌细胞同样散在于腺垂体中,只是数量较少而已。上述研究结果说明,垂体内一种细胞不是只能分泌一种相应的激素。这类多激素细胞腺瘤,称之为“异源性垂体腺瘤”。其发生机制一般认为与瘤细胞的基因表达有关,可能牵涉到基因的不稳定性和优势选择,也可能是细胞表型的变化,而没有基因潜能的变化。
近年来认为嫌色细胞腺瘤来源于分化程度较低或未分化的细胞,这种细胞可以向其他分泌激素的细胞转化,临床上可伴有相应激素分泌增多的症状,电镜下可见分泌颗粒。Leuis认为这类非功能垂体腺瘤虽有分泌颗粒,但瘤细胞分化较低,未能形成有生物效应的激素。Kovacs认为这种瘤细胞能够合成少量的激素或产生无活性的激素前体;或为目前尚未能检测的激素。Betzdorf测定瘤细胞组织培养液内生长激素的浓度,发现一些嫌色性细胞瘤与嗜酸性细胞瘤同样是升高的,这就可解释一些嫌色细胞腺瘤为什么伴有肢端肥大症。
(二)发病机制
垂体腺瘤的发病机制研究可归为两大学说:一为垂体内在异常学说,另一为下丘脑调节机制失常学说。采用分子生物学方法研究后,使长期以来一直有争议的垂体学说和下丘脑学说趋向于统一。目前认为垂体腺瘤的发展可分为两个阶段——起始阶段和促进阶段,即垂体细胞先发生突变,然后在内外因素的促进下突变的细胞增生,发展为垂体腺瘤。
1.垂体内在异常
(1)基因突变:垂体细胞的基因突变在垂体腺瘤发生中的作用近年受到高度重视,目前,已肯定的主要为一些与细胞信号转导有关的基因的点突变,这些基因包括G蛋白Gs的α亚单位(Gsα)基因、ras原癌基因、蛋白激酶C的α亚型(PKCα)基因等。
Gsα是最先明确与垂体腺瘤有关的基因。这方面的研究始于20世纪80年代中期,当时有人发现约1/3的GH腺瘤腺苷酸环化酶(adenosinecyclase,AC)活性及cAMP水平升高且不受GHRH和霍乱毒素(可通过刺激Gs而激活AC)的调节。稍后的研究证实:GH瘤细胞内AC的激活乃Gsα的突变所致。Gsα有2个突变热点,其一使201位精氨酸变成半胱氨酸或组氨酸;另一使227位谷氨酰胺变成精氨酸或亮氨酸。此2位点对于Gsα的GTP酶活性极为重要,突变使得Gsα的GTP酶活性下降,导致Gs信号系统持续地处于激活状态,于是cAMP产生增加。在垂体细胞,cAMP不仅与激素的合成和释放有关,而且参与细胞的增生。有人发现,霍乱毒素转基因小鼠的垂体出现增生,说明Gs信号系统的激活确实可引起垂体细胞的增殖。目前已知,约40%的GH瘤和约10%的无功能垂体腺瘤与Gsα的突变有关。Gsα基因现已被视为原癌基因,称为gsp。Gi也是一种G蛋白,其功能与Gs相反。Gi的突变亦与垂体腺瘤有关。有人在32例ACTH瘤中发现2例,22例无功能垂体腺瘤中发现3例有Giα亚单位的突变。Giα也已被视为原癌基因,称为gip。其他G蛋白与垂体腺瘤的关系尚不清楚。
ras原癌基因的产物P21ras在细胞的信号转导中具有重要的作用。现已发现,ras原癌基因的激活是许多人类肿瘤的重要原因。Ras基因的突变在人类垂体腺瘤中也具有一定的意义,有人研究了11例无功能垂体腺瘤、6例GH瘤和2例PRL瘤,只在1例PRL瘤中发现有ras的突变,这提示ras基因的突变在人类垂体腺瘤中较为罕见。其后的一些研究也得到相似的结论。目前认为,尽管ras原癌基因的突变在人类非内分泌肿瘤中具有重要的地位,但不是人类内分泌肿瘤的常见病因。
PKC是一类在细胞信号转导中发挥重要作用的蛋白激酶。Alvaro等发现,垂体腺瘤组织的PKC表达水平较正常垂体组织高;侵袭性垂体腺瘤PKC的表达更高。他们还发现一些侵袭性垂体腺瘤的PKCα有突变,使其294位天冬氨酸变成甘氨酸,这一突变位点正好位于PKCα分子的V3区,此区含有Ca2结合位点,上述突变导致PKCα过度激活。PKC可调节细胞外多种蛋白酶、胶原酶的活性,PKC活性的升高可促进肿瘤向正常组织的浸润。故目前认为,PKCα的突变与垂体腺瘤的侵袭性有关。
研究显示,垂体瘤组织的PTTG表达显著增加,提示PTTG在垂体瘤的形成和发展过程中具有一定的作用。目前,对PTTG的作用机制尚不清楚,但有关的研究已提供了一些信息。人PTTG蛋白含有SH3入坞基序(motif),提示它与细胞的信号传导有关。人PTTG蛋白还可诱导成纤维细胞生长因子(FGF)的表达,而FGF可促进细胞的生长和血管生成。因此,PTTG蛋白可能通过影响细胞信号转导和促进FGF的表达而发挥致瘤作用。
有些研究显示,一些垂体腺瘤瘤细胞cmyc、c-fos的表达增加,提示这些原癌基因可能也参与垂体腺瘤的发生发展。垂体腺瘤细胞可产生许多生物活性物质,包括下丘脑促垂体释放激素(TRH、CRH、GHRH)、生长因子等,这些生物活性物质在垂体腺瘤的发生发展中可能也起一定的作用。
(2)激素受体的异常:下丘脑激素或因子可作用于垂体细胞表面的受体而发挥效应,这些受体的数目和(或)亲和力的改变、表达异常、受体-G蛋白-效应器偶联异常在垂体腺瘤的发生中具有重要的作用。
①多巴胺受体:多巴胺受体有DL、D2、D3、D4、D55种亚型,它们均为G蛋白偶联受体。垂体细胞表达的为D2亚型,它有D2A和D2B2种异形体,这2种异形体是由于mRNA剪接的不同而形成的。D2B较D2A略短,其信号转导的能力较D2A为低。
②生长抑素(SS)受体:SS受体(SSTR)有5种亚型:SSTR1、SSTR2、SSTR3、SSTR4和SSTR5,它们与SS-14和SS-28都能高亲和力地结合。SS类似物奥曲肽(octeotide)与SSTR2和SSTR5的亲和力较高,与SSTR3的亲和力中等,与SSTR1和SSTR4的亲和力则较低。SS及其类似物抑制GH释放的作用主要由SSTR2介导:SSTR2激活后可抑制AC的活性,使K通道开放,细胞超极化,于是细胞膜上的电压依从性Ca2通道关闭,引起[Ca2]i下降,从而抑制GH的释放。SS及其类似物抑制GH细胞增生的作用主要由磷酸酪氨酸磷酸酶的激活来实现,由SSTR2和SSTR5共同介导。
GH瘤细胞表达多种SSTR亚型,其中比较重要的为SSTR2和SSTR5,此2亚型激活后可使[Ca2]i和cAMP水平降低,故既能抑制GH的释放又能阻止GH细胞的增生。体外结合实验表明:SS结合位点的数目与肿瘤对SS类似物的反应性相关,结合位点越多则SS类似物的治疗效果越好。gsp突变性GH瘤的SS结合位点一般较多,此种肿瘤对奥曲肽的反应较好。
用核酸杂交技术在PRL瘤、ACTH瘤、TSH瘤及无功能垂体腺瘤中也检测到各种亚型SSTR的mRNA,说明这些肿瘤细胞中也有SSTR的表达。这些受体激活后也可引起[Ca2]i和cAMP水平的下降,提示它们也具有功能。但是,有些肿瘤细胞上的SSTR兴奋后却使[Ca2]i升高,这可能因SSTR-G蛋白-效应器偶联异常所致。
③TRH受体:TRH受体也属于GPCR,它与Gq偶联,兴奋后可激活磷脂酶Cβ(PLCβ),使[Ca2]i升高。大多数PRL瘤细胞存在高亲和力TRH受体,但这些肿瘤对TRH无反应,原因未明,推测可能与受体后缺陷有关。TSH瘤罕见,是否含有TRH受体尚不清楚。有些学者基于大多数TSH瘤对TRH无反应这一事实,认为TSH瘤不表达TRH受体或虽表达但表达产物无功能。与PRL瘤和TSH瘤相反,不少GH瘤(40%~50%)、无功能垂体腺瘤(30%~50%)、ACTH瘤(20%~30%)、促性腺激素瘤(70%~80%)对TRH有反应,说明这些肿瘤表达TRH受体,这一点虽无治疗意义但却有一定的诊断价值。
④GnRH受体:GnRH受体也属于GPCR,受体兴奋后可激活磷脂酶Cβ,使[Ca2]i升高,产生一系列效应。绝大多数促性腺激素瘤表达GnRH受体,对GnRH有反应。有些促性腺激素瘤对GnRH无反应,原因可能是这些肿瘤的GnRH受体后信号转导系统有缺陷。促性腺激素瘤细胞的GnRH受体同正常的GnRH受体有明显的不同:后者在受到持续性GnRH刺激时表现出失敏现象,即不再对GnRH有反应;前者无失敏现象,即对GnRH的持续刺激仍有反应。由于促性腺激素瘤的GnRH受体不存在失敏现象,故长效GnRH类似物对这些肿瘤效果不佳。
有15%~20%的GH瘤和ACTH瘤也表达GnRH受体,这些患者在给予GnRH后血GH或ACTH水平明显升高,说明这些受体是有功能的。大多数无功能垂体腺瘤患者在接受GnRH后血促性腺激素和(或)其亚单位水平升高,说明无功能垂体腺瘤也存在GnRH受体。
⑤GHRH受体:大多数GH瘤表达有GHRH受体,这些肿瘤对GHRH有反应。核酸杂交研究显示,GH瘤对GHRH的反应性与GHRH受体mRNA水平之间无相关关系。其他垂体腺瘤如PRL瘤、ACTH瘤及无功能垂体腺瘤也含有GHRH受体,但表达水平低,这些肿瘤对GHRH的反应也差。GHRH受体无失敏现象。
⑥CRH受体:CRH受体也属GPCR,受体活化后可激活AC。ACTH瘤表达有CRH受体,这是它们对CRH有反应的基础。ACTH瘤的CRH受体既不受皮质醇的调节,也不受CRH的调节。非ACTH瘤罕有CRH受体的表达。
2.调节机制的失常很早就有人提出,激素调节机制的失常是引起垂体腺瘤的重要原因,支持这一学说的证据有:下丘脑GHRH瘤和CRH瘤可分别引起垂体GH瘤和ACTH瘤;异位GHRH也能引起GH瘤,惟作用较下丘脑GHRH瘤为弱(原因可能是后者产生的GHRH直接进入垂体门脉系统,故垂体局部GHRH浓度较高)。近年的动物实验证明:GHRH转基因小鼠极易发生GH瘤。这些均说明下丘脑促垂体释放激素在垂体腺瘤的发生中具有重要作用。那么,下丘脑抑垂体激素(因子)的缺乏是否也能引起垂体腺瘤呢?这方面尚缺少有说服力的证据。一些研究显示,PRL瘤的病人下丘脑多巴胺水平并无下降,提示下丘脑抑制因子的缺乏在垂体腺瘤的发病中可能不起重要的作用。
外周靶腺激素水平的下降可减弱其对垂体的抑制作用,从而促进相应的垂体细胞的增生,如Cushing病患者切除双侧肾上腺后可使原已存在的ACTH微腺瘤转变成大腺瘤(Nelson综合征)。有研究指出,原发性性腺功能减退者垂体腺瘤的发病率并不高于普通人群;原发性甲状腺功能减退者虽有TSH细胞的增生但罕有TSH瘤,这些提示外周靶腺激素的缺乏不是垂体腺瘤发生的始动因素。
近年,一些学者运用分子生物学技术对垂体腺瘤细胞的克隆性作了研究,这使得人们对垂体腺瘤的发生机制有了新的认识。根据下丘脑调节失常学说,垂体腺瘤应为多克隆起源;根据垂体起源学说,垂体腺瘤应为单克隆起源。Alexander等的研究表明,几乎所有垂体腺瘤都是单克隆起源的,这一结果有力地支持了垂体起源学说。然而,这并不意味着下丘脑调节机制失常在垂体腺瘤的发生中不起作用。事实上,垂体腺瘤的发生可能是多阶段的(multistage),其始因为垂体细胞的内在异常(如基因突变),在此基础上如下丘脑调节机制发生紊乱则进一步刺激垂体细胞的增殖,最后形成肿瘤。下丘脑调节机制失常可能为形成垂体腺瘤的促进因素。但是,长期过量的下丘脑促垂体释放激素的刺激可诱使相应的垂体细胞发生突变,这可解释何以下丘脑促垂体激素瘤能引起相应的垂体腺瘤。
随机尸检和用高分辨率MRI所作的人群普查结果表明,微小的无症状垂体腺瘤是相当常见的(约10%),但临床显性垂体腺瘤的患病率则很低(1/500~1/1000),这说明垂体内在异常作为垂体腺瘤发生的始发事件是相当常见的,但必须同时合并存在其他的促进垂体细胞增生的因素方可进一步形成显性垂体腺瘤。影响垂体细胞增生的因素可能也不限于下丘脑激素或因子,垂体局部的自分泌/旁分泌因子及某些性腺肽类也起着重要的作用,它们可能也参与垂体腺瘤的发生发展。
有一些研究认为垂体腺瘤与病毒感染有关。有报道称,接种鼠多瘤病毒的小鼠易发生垂体腺瘤;多瘤中间T抗原(polyomamiddleTantigen)转基因小鼠也易患垂体腺瘤。但这些研究未能为人类的流行病学资料所证实,说明病毒感染与人类垂体腺瘤的关系不大。
术中看到的正常垂体为橘红色,质韧,而腺瘤常为紫红色且质软,有的呈烂泥状,当有变性时,瘤组织可呈灰白色;有的伴瘤组织坏死、出血或囊性变。在光镜下结合尸检材料,垂体腺瘤外有边界,但无包膜。大的腺瘤部分可以垂体的硬膜为包膜。瘤组织不同于腺垂体组织。一般说,瘤细胞形态较一致,但呈圆形、立方形或多角型的瘤细胞的大小差异很大:小的与淋巴细胞相似,仅在核外有少量胞质,这些多是未分化的干细胞;大的胞质较多,其中可充满一些颗粒或呈泡沫状,瘤细胞的大小较一致,亦常见大核和双核,偶尔环状核即核凹入,把一部分胞质包入核内,很少看到核分裂。
近些年来,由于内分泌激素测定的进步和电子显微镜下观察超微结构以及染色方法的改进、特异性免疫组织化学染色在病理上的广泛应用,现在一个比较好的把形态(组织化学和电镜)和功能(临床表现)相结合的垂体腺瘤的新分类已经形成。这个新分类是:①泌乳素细胞腺瘤(PRL腺瘤):PRL腺瘤占垂体腺瘤的40%~60%,临床表现女性为闭经-溢乳(Forbes-Albright综合征),男性为阳痿,性功能减退等。血浆中PRL水平升高。瘤细胞多为嫌色性,呈乳突状排列,瘤内可有小钙化灶。少数瘤细胞为嗜酸性。在电镜下,分泌颗粒多少不等。大多数瘤细胞内分泌颗粒较少,体积较小,在120~300nm;体积较大的,最大长径达1200nm,形状不规则,可为圆形、卵圆形、短杆状、泪滴状。电子密度大而均匀,在核旁Golgi体附近与粗面内质网一起形成泌乳素小体。少数分泌颗粒可在胞膜外,如分泌颗粒错位胞溢。用免疫组织化学染色呈PRL阳性。较长期溴隐亭治疗后可导致肿瘤钙化,内分泌淀粉样变沉着,血管周围和间质纤维化,可影响手术疗效。泌乳素细胞增生引起高泌乳素血症,极罕见于外科标本中,偶在肿瘤周围可见到。②生长激素细胞腺瘤:占分泌性腺瘤的20%~30%,临床主要表现为肢端肥大症或巨人症,血浆中GH水平升高,并引起全身代谢紊乱。在HE染色中,瘤细胞可呈强或弱嗜酸性,橘黄G染色(+),PAS(-)。在电镜下,根据细胞分泌颗粒的多少分为:A.浓密颗粒型:颗粒直径大多为200~350nm,颗粒多而密集、圆形、密度大而均匀。其他细胞器很少。B.稀疏颗粒型:颗粒直径大多在100~250nm,颗粒少而散在,胞核形态变异较大,在核凹入部有圆形纤维小体,含有数目不等、长短不一的微纤维,核旁常见中心粒。用免疫组化染色,细胞质内GH阳性,其染色深浅与细胞内GH分泌颗粒的多少成正比。浓密型和稀疏型分泌颗粒在临床和生化上无区别,但在年轻人稀疏型肿瘤可能生长较快、较大,切除较困难,也容易复发。③促肾上腺皮质激素细胞腺瘤:占垂体腺瘤的5%~15%,临床表现为皮质醇增多症(Cushing综合征),可引起全身脂肪、蛋白质代谢和电解质紊乱。当切除肾上腺皮质后可出现Nelson综合征,多数腺瘤较大,并有侵蚀现象。微腺瘤瘤体埋在腺垂体中后部;或由于ACTH细胞增生(结节性,弥漫性,多数为混合性)。瘤细胞可为嗜碱性或嫌色性。PAS(+),橘黄(-),红素(-)。瘤细胞常呈筛网状排列。在电镜下,细胞内分泌颗粒多少不等,直径150~450nm,电子密度极不均匀,深浅不等,或有中心空泡,核旁有成束的平行排列的微纤维积聚,可伴Crooke透明变性细胞。免疫组织化学染色细胞呈ACTH阳性。④促甲状腺素细胞腺瘤:此瘤罕见,不足1%。血浆中TSH升高。临床表现为甲亢或甲低。瘤细胞较小,PAS(+)。在电镜下瘤细胞颗粒小而圆、直径为50~150nm,密度不均匀。胞质中散在平行排列的微小管。用免疫细胞化学染色呈TSH阳性。⑤促性腺激素腺瘤:很罕见。血中性激素升高,临床上可有性功能失调,如阳痿、性欲减退等表现。很少单独存在,常与其他激素细胞如PRL细胞并存。分泌颗粒圆而小,直径150~250nm。用免疫细胞化学染色示LH和FSH阳性。⑥多分泌功能细胞腺瘤:在临床上腺瘤内含有2种或2种以上的分泌激素细胞。有多种内分泌功能失调症状的混合征候。最常见的是GH+PRL,此外还有GH+ACTH,PRL+ACTH,PRL+LH或FSH,GH+ACTH+TSH。这些细胞可用免疫细胞化学染色法显示出。⑦无内分泌功能细胞腺瘤:占垂体腺瘤的20%~35%。这种肿瘤临床上无明显内分泌失调症状。当瘤体较大时,可出现视交叉压迫和颅内压增高症状或伴垂体功能低下的症状。本瘤可包括大嗜酸性细胞腺瘤和未分化细胞瘤,Kovacs等又称裸细胞腺瘤。胞质较丰富,染色较淡,无特殊染色颗粒。瘤细胞围绕血管及间质,呈乳突状排列,有的可见腺样分化,或弥散生长,胞核圆,染色质丰富。瘤内血管或血窦较丰富,易发生出血。若用免疫细胞化学方法,肿瘤内可含GH、PRL或GnH细胞,分泌颗粒小而稀疏,直径为50~200nm,无细胞排粒作用,所测激素多为糖蛋白类激素为α-亚单位。部分亚单位激素因无生物活性而无临床症状。
检查
垂体腺瘤的常规实验室检查多无异常。对垂体腺瘤来说,重要的是各种内分泌功能检查。由于病变及病程的不同,垂体腺瘤的内分泌功能检查可有不同结果。
1.生长激素(GH)由垂体GH细胞分泌,受下丘脑调节,疑诊GH腺瘤时,应测GH基础值和葡萄糖抑制试验。禁食12h后,休息情况下的GH正常值2~4μg/L,易受情绪、低血糖、睡眠、体力活动和应激状态等影响,约90%的GH腺瘤病人GH基础值高于10μg/L。GH水平在5~10μg/L可以是GH腺瘤,但个别情况也见于正常人,因此,应做葡萄糖抑制试验。正常人口服葡萄糖100g后2h,GH低于正常值,3~4h后回升。GH腺瘤病人不受此影响,呈不能抑制现象。血浆胰岛素样生长因子1(IGF-1)浓度测定可反映24hGH的分泌情况和CH腺瘤的活动性。GH的TRH兴奋试验,胰岛素低血糖兴奋试验,如GH不升高则表示GH储备能力不足。还有生长介素,主要在GH刺激下的肝脏产生,可促进GH对周围组织的调节,测定生长介素,对GH腺瘤的诊断和治疗后随诊有帮助,但术后并不像GH水平立即降低,而是缓慢降低。
2.ACTH检查内分泌学检查对库欣综合征及其病因的诊断和鉴别诊断的意义尤为重要。因ACTH垂体腺瘤中绝大多数为微腺瘤(约80%),其中直径100µg有诊断意义。检查需分两步:第一步要查清是否为库欣综合征,第二步要明确是否为垂体源性即库欣病(垂体ACTH腺瘤和垂体ACTH细胞增生)。大多数病人血浆ACTH中度增高或正常,血浆皮质醇升高,且昼夜节律消失,24h尿游离皮质醇(UFC/24h)升高,小剂量地塞米松抑制试验不能抑制,大剂量地塞米松能抑制(皮质醇比对照值降低50%以上),对明确诊断有特殊意义。如血浆ACTH不高,而皮质醇明显增高,节律消失,大、小剂量地塞米松均不能抑制,则符合肾上腺源性(肾上腺腺瘤或肾上腺癌)。如血浆ACTH明显增加,节律消失,大、小剂量地塞米松均不能抑制者,多支持异位源性库欣综合征(如肺癌、支气管类癌等)。在采用17-OHCS为指标的诊断符合率为80%左右,北京协和医院采用UFC/24h为指标,符合率可达92.5%。对诊断困难者,可行ACTH刺激试验,胰岛素低血糖诱发试验。如有条件可行选择性静脉导管,采集双侧岩下窦、颈内静脉、下腔静脉血测定ACTH,以及美替拉酮试验和CRH试验,这些对诊断和鉴别诊断有重要意义。
3.甲状腺刺激素垂体TSH细胞分泌TSH,血浆TSH正常值为5~10μU/ml,TSH增高可见于垂体TSH腺瘤、下丘脑性甲亢、原发性甲低、甲状腺炎和甲状腺肿瘤等病例。TSH减低可见于垂体肿瘤、炎症或脓肿、手术和创伤后,有时需作甲状腺刺激素释放因子(TRHRH)兴奋试验,以了解垂体储备功能。应用TSH5~10单位肌内注射后测定甲状腺素或甲状腺吸碘率可增高,提示腺垂体功能减退。
4.促性腺激素腺垂体FSH和LH细胞分泌FSH和LH,FSH正常值为120μg/L,LH为40μg/L。垂体FSH/LH腺瘤时,FSH/LH水平增高。垂体功能低下时,FSH和LH低,需同时测定睾酮和雌激素及其他激素协助诊断,还可作阴道黏膜涂片或精子数目帮助诊断。
5.黑色素刺激素正常人血浆,MSH水平为20~110pg/ml,MSH增高可见于垂体功能减低病人,增生型皮质醇增多症。肾上腺皮质腺瘤所致皮质醇增多症中MSH减低。
6.靶腺细胞分泌功能如果垂体腺瘤长期压迫垂体组织,或垂体卒中,手术创伤,致垂体功能不足,甲状腺、肾上腺、性腺等靶腺等可发生功能低减。甲状腺蛋白结合碘、甲状腺素、17酮、17羟、尿游离皮质醇均低下,睾酮、雌激素低下,精子数目减少;阴道涂片,雌激素低于正常。
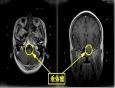
1.垂体微腺瘤的CT和MRI表现
(1)直接征象:垂体内低密度(信号)区是诊断垂体微腺瘤的可靠征象(图1)。低密度(信号)区在3mm以上或超过垂体体积的1/3即可诊断为垂体微腺瘤。低密度(信号)区的显示与垂体及肿瘤的造影剂充盈方式有关。造影剂快速增强扫描时,由于垂体的血供极其丰富,且无血-脑脊液屏障,注入造影剂后可立即增强,其增强的程度与海绵窦及颈内动脉相接近。而肿瘤组织的血供不及垂体丰富,增强不及垂体迅速,肿瘤密度(信号)增加缓慢,因而在注入造影剂的一瞬间,肿瘤与邻近垂体组织或海绵窦相比呈低密度(信号)。随着时间的推移,循环血中的造影剂浓度逐渐降低,垂体与海绵窦的密度(信号)均逐渐下降,肿瘤组织逐渐呈等密度(信号)。因此,快速增强扫描可使低密度(信号)区的显示最佳,而延长注射造影剂至扫描完成的时间则会造成漏诊。少数微腺瘤表现为或高密度(信号)区,表现为等密度(信号)区的微腺瘤只能依据占位征象进行诊断。
(2)占位征象:
①垂体增高和(或)上缘膨隆:垂体高度超过8mm即提示可能存在微腺瘤。但正常垂体高度也可能>8mm。另外,垂体高度正常也不能否定微腺瘤的存在,因此不能单纯用垂体高度作为微腺瘤是否存在的惟一标准,必须结合其他CT表现。垂体增高且上缘膨隆,则高度提示微腺瘤的存在,若垂体上缘的隆起不对称,则更支持微腺瘤的诊断。有人报道,垂体增高且上缘隆起不对称,91%有肿瘤存在。垂体上缘呈普遍性隆起只有部分病例中线区有肿瘤存在。因为正常垂体上缘也可膨隆,故观察垂体上缘形态也需结合其他征象。
②垂体柄移位:肿瘤的占位效应可将垂体柄推向对侧,但在少数情况下,垂体柄也可向肿瘤同侧移位。另外,动态增强扫描可见垂体柄周围毛细血管丛,微腺瘤的占位效应也可导致此毛细血管丛的移位。垂体柄偏离中线2mm以上,常常提示微腺瘤的存在。同样,在分析垂体柄的变化时也需结合其他CT征象,因为微腺瘤病人垂体柄可以不移位,而正常人的垂体柄又可略偏离中线。
③神经垂体消失:冠状CT扫描在通过垂体后缘的层面上,在鞍背前方常可见到略低密度的卵圆形后叶;而MRI检查可更清晰地显示神经垂体。微腺瘤的占位效应常导致后叶受压缩小而不能显示,或被挤向一侧。但若肿瘤发生于前叶前部,体积又较小,其占位效应不重,则仍可见到后叶。故神经垂体消失常常提示有微腺瘤,而后叶显示良好也不能完全排除微腺瘤。
④鞍底骨质的变化:微腺瘤可导致鞍底骨质的吸收或破坏,使鞍底两侧厚度不一,CT表现为鞍底一侧变薄或破坏。但正常人鞍底厚度有较大变异,只有骨质改变伴有相应部位的其他异常表现时,才可认为异常。
总之,垂体是否异常或是否存在微腺瘤,应从垂体高度、上缘形态、内部密度(信号)、异常密度(信号)区的存在及其大小、密度(信号)及边界、垂体柄的移位、神经垂体及鞍底骨质的变化等几方面进行仔细观察,垂体柄移位、后叶消失及鞍底骨质的变化,可提示有微腺瘤存在。
2.垂体大腺瘤的CT和MRI表现CT和MRI检查是诊断垂体腺瘤最主要的影像学方法,不仅可以做出定性诊断,而且还可以了解肿瘤的大小、形态、质地以及与周围结构之间的关系(图2),为治疗方法的选择提供和依据。
非增强扫描可见蝶鞍扩大,鞍底和鞍背骨质吸收变薄、倾斜;肿瘤位于脑外,由鞍内向鞍上生长,占据鞍上池、第三脑室前部甚至达室间孔水平,但极少因此出现梗阻性脑积水;肿瘤可呈实体性或囊实性,无钙化,边界清楚,呈类圆形或哑铃型;两侧海绵窦受肿瘤推移挤压外移,少数肿瘤侵袭海绵窦,包绕颈内动脉甚至使该侧海绵窦明显外移;有时肿瘤可明显向额叶或颞叶发展,或者突入蝶窦。增强扫描可见实体性肿瘤呈均一中度强化,囊性肿瘤呈周边强化,中小体积肿瘤在肿瘤周边可见残存垂体。
3.普通X线检查:头颅正侧位片可显示蝶鞍形态,但不能显示垂体,因此如果垂体腺瘤仅在鞍内生长而未影响蝶鞍形态,则头颅正侧位片可无异常。如肿瘤侵及蝶鞍则可在头颅正侧位片上形成一系列表现,如蝶鞍扩大;鞍壁脱钙、变薄;前、后床突变细甚至缺如;鞍底变阔、下陷;如肿瘤偏于一侧则可使另一侧鞍底下陷明显,侧位片上呈现出双鞍底。
分层摄影、气脑造影、脑室造影和血管造影对垂体腺瘤的诊断也有一定意义,但由于这些检查多较复杂且有一定的危险性,加之CT和MRI的普及,现已很少使用。
4.PET检查PET作为一种功能显像技术,自20世纪80年代应用于临床以来已取得很大的成功。PET可提供有关肿瘤生化特征、代谢特性、受体分布及酶学特点等方面的信息,在肿瘤的诊断、治疗等方面均有重要的意义。
PRL瘤及某些无功能腺瘤常有代谢增强,因此,用11C标记的左旋蛋氨酸和18F标记的氟脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG)可使其显像。用多巴胺受体激动药治疗后,瘤细胞的代谢降低,其摄取11C-左旋蛋氨酸和18F-FDG的能力也下降。11C标记的多巴胺D2受体拮抗药甲基螺哌隆(methylspiperone)和雷氯必利(raclopride)可使PRL瘤显像,且可预测多巴胺受体激动药的疗效。一般来说,11C标记的甲基螺哌隆和雷氯必利显像者对多巴胺受体激动药的反应良好。
鉴别
无分泌功能腺瘤应与鞍区其他疾病相鉴别:
1.颅咽管瘤多见于儿童及青少年,肿瘤常发生于鞍上,可向第三脑室、鞍旁、鞍后等处发展。临床表现为下丘脑、垂体功能损害症状如尿崩、发育迟缓等,视野改变多不规则,常有颅压增高。蝶鞍改变为鞍背缩短、鞍底平坦,70%可见钙化斑。CT为鞍上囊性低密度区,囊壁呈蛋壳样钙化,实体肿瘤为高密度区,可有强化。MRI示鞍区囊性占位的信号,鞍内底部往往可见正常垂体。成人颅咽管瘤常见于鞍内,多为实质性,有时鉴别较难,需手术后才能确诊。
2.脑膜瘤常有头痛、视力视野改变,但内分泌症状多不明显。蝶鞍一般正常大小,但鞍结节附近可见骨质增生。CT为均匀高密度病灶,增强明显。MRI扫描T1W呈等信号,T2W呈高信号,增强后有时可见脑膜“尾征”。鞍内亦可见正常垂体。
3.异位松果体瘤多见于儿童及青春期者,尿崩常为首发症状,有的可出现性早熟、发育停滞及视路受损症状。蝶鞍多正常,CT为类圆形高密度灶,其内见有钙化点,有明显均匀增强;MRI扫描示垂体柄处实体性肿块。
4.视神经和下丘脑胶质瘤前者多发生于儿童,为患侧失明及突眼,平片可见患侧视神经孔扩大,蝶鞍正常。后者有下丘脑受损症状和视野变化,MRI扫描可确定肿瘤范围。
5.脊索瘤常位于颅底斜坡,可向鞍区侵犯,出现头痛、多发性脑神经麻痹及视力视野改变,内分泌症状不明显。X线平片及CT均可显示斜坡区骨质破损和钙化,肿瘤密度不均匀。
6.皮样及上皮样囊肿可有视力减退及视野改变,但双颞偏盲少见,其他脑神经损害症状轻微,垂体功能常无影响。X线偶见颅底骨质吸收,CT为低密度或混合密度病灶。
7.动脉瘤可有视力视野及蝶鞍改变,但病史中常有蛛网膜下腔出血史。症状多突然发生,有头痛、动眼神经麻痹等。脑血管造影可明确诊断。
8.视交叉蛛网膜炎或囊肿起病缓慢,视野变化不典型,蝶鞍无典型改变。无垂体功能减退症状。CT及MRI扫描可予鉴别。
9.Rathke囊肿发生于垂体中间部,较少见。可引起垂体功能减退、蝶鞍扩大、视交叉受压等症状。与鞍内型颅咽管瘤和无分泌功能垂体腺瘤较难鉴别,需手术方能确诊。
10.空蝶鞍综合征可有视路压迫症和轻度垂体功能低下,蝶鞍常球型扩大,脑池造影CT扫描发现造影剂进入蝶鞍的蛛网膜下腔。
11.垂体脓肿可表现为头痛、视力视野改变及内分泌低下症状。部分病人可找到感染源,体检有脑膜刺激症。但临床上常鉴别困难。
并发症
1.手术治疗的并发症
(1)鞍内并发症:包括颈内动脉损伤(占0.4%~1.4%),可引起假性动脉瘤、颈内动脉-海绵窦瘘,术后大血管痉挛、闭塞,及脑神经损伤(占0.4%~1.9%),尤以展神经损伤为多见。
(2)鞍上操作所致并发症:包括下丘脑、垂体柄、垂体损伤;视神经、视交叉及周围血管的损伤导致视力减退或失明(占0.4%~2.4%),后者也可由残余肿瘤出血、肿胀、鞍内填塞物过多等原因引起;鞍膈及蛛网膜损伤破裂发生脑脊液漏(占1.5%~4.2%,甚高达9%~15%),可引起气颅、脑膜炎(占0%~2%);其他尚有蛛网膜下腔出血、双额硬膜外血肿、癫痫等。
(3)经蝶入路及蝶窦内并发症:可有鼻中隔穿孔(3.3%~7.6%),上唇及牙齿麻木,鼻畸形,上颌骨、眶骨、筛骨等骨折,蝶窦炎(1%~4%)或脓肿,以及在蝶鞍前下壁两侧的蝶窦腔内损伤颈内动脉襻(动脉表面覆盖骨缺损,仅有黏膜者约占4%)和在蝶窦腔的上侧方(有视神经孔的下中壁骨缺损者)损伤视神经。
(4)内分泌症状:有10%~60%的患者可发生尿崩症,大多为短暂性,持续性者占0.5%~15%。术后垂体功能不足的发生为1%~10%,多为大腺瘤,且术前已有垂体功能低下者。
2.放疗后的并发症
(1)放射性坏死:一般发生的高峰期在放疗后1~3年,若放射剂量≤45Gy,其发生率仅0.4%。部位可涉及双侧额叶下内方、颞叶前内侧钩回、下丘脑及视交叉、第三脑室前壁等。临床表现为视力、视野症状加重,丘脑下部症状及头痛、恶心等。常可误为肿瘤复发。治疗以支持疗法为主,给予大量维生素、能量合剂及替代性激素治疗。
(2)新生物形成:最常见为胶质瘤、脑膜瘤、纤维肉瘤,其发生的危险性是正常人群的9~16倍,常在数年甚至10年以后发生。
(3)垂体功能低下:经8~10年随访,其发生率在13%~30%,甚至更高,表现为性腺、甲状腺和肾上腺轴的功能减退,需激素替代治疗。
(4)其他并发症:如肿瘤内出血或囊变、空蝶鞍综合征、视神经损害等,均以视力再度减退为特征,亦可误为肿瘤复发。
治疗
(一)治疗
1.治疗选择垂体腺瘤的治疗方法有手术治疗、放射治疗及药物治疗。由于垂体肿瘤的大小不同,各种类型垂体腺瘤对以上治疗方法的效果不同,以及病人年龄及一般情况的不同,故每一病人的治疗方案均需考虑各种因素的影响问题。一般来说,手术治疗适用各种类型的较大垂体腺瘤、微腺瘤中的ACTH型、GH型以及药物治疗不能耐受或治疗不敏感的PRL瘤;药物治疗适用于PRL微腺瘤、TSH微腺瘤以及部分分泌性大腺瘤术后的病人;放射治疗适用于术后肿瘤残留的病人,或不愿意手术的ACTH或GH微腺瘤病人。而高龄患者、身体情况差者可选择药物治疗或放射治疗。
垂体ACTH瘤80%以上为微腺瘤,因药物治疗效果差,故经蝶入路手术是其最佳的选择。过去由于早期诊断困难,病人表现为库欣综合征、双侧肾上腺增生,常误行肾上腺切除术。随之垂体失去靶腺的反馈调节,微腺瘤迅速增大,10%~30%病人出现纳尔逊综合征。目前由于认识上的改变,对80%~90%库欣病已从肾上腺手术转向垂体肿瘤的切除,并取得远较过去满意的效果。国内外治疗该肿瘤的手术治愈率在60%~85%,儿童患者的治愈率更高。而肿瘤复发率仅2%~11%,对肿瘤复发者可再次经蝶手术。
与库欣病一样,经蝶入路手术也是肢端肥大症(GH瘤)的首选治疗方法。术后数小时,患者GH水平可明显下降,出院前软组织增大可渐消失。GH瘤的手术治愈率在58%~82%,术后复发率在5%~12%。对肿瘤未切尽或激素水平未恢复正常者,可行放疗或药物治疗。
PRL瘤,尤其是大腺瘤也是手术的适应对象,术后视力可改善,大部分病人激素水平恢复正常。然而肿瘤术后的复发率较高,长期随访复发率为6%~40%。由于多巴胺促效剂溴隐亭对该瘤有明显治疗作用,又因高PRL血症病人经长期随访后,大多数小腺瘤不长成大腺瘤,且激素水平无变化,甚至恢复正常。故近来对PRL微小腺瘤的治疗选择趋向于保守或选用药物治疗。
TSH腺瘤罕见,选择治疗需慎重。当肿瘤较小或是继发于原发性甲状腺功能减退症的通常不需要手术处理,应用药物甲状腺素替代治疗多能奏效。但对肿瘤较大向鞍上生长压迫视路者,可考虑手术切除。必须对原发和继发的TSH瘤及非肿瘤形式者(后者可受到TRH的进一步刺激)提高认识,作出鉴别,否则可产生不良后果,如在原发性甲状腺功能减退病人作不必要的垂体手术,在中枢性甲状腺功能亢进病人中作不恰当的甲状腺切除。
一般说来,促性腺素瘤同无分泌功能腺瘤一样,大多为大腺瘤。根据肿瘤大小、形状、生长方向可选择经蝶或经颅入路手术。术后视路改善者近70%,但肿瘤复发率较高。
2.手术治疗手术切除肿瘤是目前治疗垂体腺瘤的主要手段。手术的目的是解除肿瘤对视路和其他组织的压迫,恢复激素水平,保护正常垂体功能。许多肿瘤通过经颅或经蝶入路手术能被有效治疗。但手术也受到包括肿瘤特征如肿瘤大小、形状、生长方向、组织类型、鞍外扩展程度和病人的特征如年龄、健康状况、视路和内分泌损害程度以及蝶鞍、蝶窦的解剖等情况的影响。在决定手术入路时,肿瘤的体积和蝶鞍扩展程度不如肿瘤的形状和生长方向来得那么重要。在当今显微外科技术较为普及的情况下,对待可以安全经蝶或经颅入路手术的病人,一般倾向于经蝶入路手术。因为经蝶入路更快更直接地达到垂体腺,清晰地区分肿瘤组织和垂体腺,肿瘤切除的彻底性较高,而病人的手术风险及术中损伤视路等结构的可能性小,病人的术后反应轻、恢复快。
(1)经颅手术:垂体腺瘤常规经颅手术有经额下、额颞(翼点)和颞下入路,每一种入路在特殊情况下有各自优缺点。垂体腺瘤额下入路手术可观察视神经、视交叉、颈内动脉、鞍上池、垂体柄和蝶鞍,术中可在直视下切除肿瘤,对视神经、视交叉减压较彻底,适用于较大垂体腺瘤向鞍上发展有视力视野障碍者,但前置型视交叉可阻碍这一入路接近肿瘤,故对临床(视野检查有双颞偏盲性暗点)和MRI估计有视交叉前置者应优先采用额颞(翼点)入路。该入路提供了在视神经及视束与颈内动脉之间操作的空间,也可在视交叉前、下及后方探查,且路径短、视角大,充分利用了脑的自然解剖间隙,故适用于垂体腺瘤向视交叉后上方、向鞍旁或海绵窦发展者。缺点是手术者对远侧视神经和鞍内容物的视域受到影响。颞下入路适用于肿瘤明显向视交叉后扩展的罕见情况或向鞍旁发展者,虽然这一入路可对视交叉进行减压,但它对鞍内肿瘤的切除困难。
近10年来,随着颅底外科的突破性进展,垂体腺瘤的新手术入路和改良的手术入路得到开发和应用,包括扩大的额下硬膜外入路、经眶额蝶联合入路和经硬膜外海绵窦入路。扩大的额下硬膜外入路能清楚显露颅底的中线区域,如筛窦、蝶窦以至斜坡,故适用于切除长向前颅底、蝶窦、筛窦、鞍区及斜坡的巨大垂体腺瘤。但有些肿瘤长向鞍上区、后床突区及鞍旁海绵窦,成为该手术入路的“盲区”。为解决这一难点,可采用术中联合额下或颞下硬膜内入路一起操作,以增加肿瘤切除的彻底性。该入路暴露范围较经蝶入路广,手术风险较常规经颅入路小,手术需特别注意的是严格修复颅底硬膜,以防术后脑脊液漏和颅内感染。经眶额蝶联合入路是经额和经蝶联合入路的改良,手术野暴露好,容易达到肿瘤全切除目的,但手术创伤大,同样可能有脑脊液漏和颅内感染。经硬膜外海绵窦入路适用对象为侵入鞍旁和(或)鞍上的垂体腺瘤,尤其是常规额下入路或经蝶入路手术复发者。主要手术方法为:①游离中颅底硬脑膜夹层,打开海绵窦外侧壁。②经海绵窦内侧三角、上三角、外侧三角等间隙切除肿瘤及视神经两旁切除侵入蝶窦和筛窦的肿瘤。③肿瘤长向鞍上者,可剪开硬脑膜,打开侧裂,抬起额叶,将隆起的鞍膈连同其下的肿瘤推入蝶鞍内,经硬膜外切除。
经颅手术指征有:①肿瘤向鞍上生长呈哑铃状;②肿瘤长入第三脑室,伴有脑积水及颅内压增高者;③肿瘤向鞍外生长至颅前、中或后窝者;④有鼻或鼻窦炎症及蝶窦气化不能良且无微型电钻设备,不适合经蝶窦手术者;⑤肿瘤出血伴颅内血肿或蛛网膜下腔出血者。
术后视力及视野恢复率为78%,其中视力改善为83%,视野改善为67%,其疗效与以下因素有关:①术前视觉影响程度,即术前视力影响愈严重,术后恢复可能愈小。②视神经受压时间长短,一般视力障碍在1年以内者,术后恢复大多良好,视觉障碍在2年以上者恢复较差。③视神经萎缩程度,已有明显视神经萎缩者,往往不能完全恢复。
(2)经蝶手术:经蝶窦入路切除垂体腺瘤为Schloffer(1907)首先在人体手术成功,后经改进,成为目前最为广泛应用的垂体腺瘤手术方法,它包括经口-鼻-蝶窦、经鼻-蝶窦、经筛-蝶窦、经上颌窦-蝶窦入路等术式。其优点是手术安全度高,采用显微手术技术,对微腺瘤可作选择性全切除,保留正常垂体组织,恢复内分泌功能。近年来,随着经蝶手术经验的不断积累和手术技巧的提高,注意到垂体腺瘤鞍上扩展部分常为非浸润性生长,包膜完整,且绝大多数垂体腺瘤组织质地脆软,有些肿瘤伴有出血、坏死、囊液等改变,容易被吸除或刮除,故国内不少医疗单位对有视神经及视交叉受压的大或巨腺瘤亦乐于采用经蝶入路手术,并能达到肿瘤尽可能多地切除,视路减压满意及保存垂体功能的目的,取得了较好的疗效(占83%)。国外也有学者对垂体大腺瘤采用经蝶入路、鞍底开放,有意待肿瘤坠落至鞍内后作二期手术的,有效率亦可达83%。
经蝶入路手术指征一般包括:①垂体微腺瘤;②垂体腺瘤向鞍上扩展,但不呈哑铃形,未向鞍旁侵袭,影像学提示肿瘤质地松软者;③垂体腺瘤向蝶窦内生长者;④垂体腺瘤伴有脑脊液鼻漏者;⑤垂体腺瘤卒中不伴有颅内血肿或蛛网膜下腔出血者;⑥视交叉前置型垂体腺瘤;⑦患者年老体弱,不能耐受开颅手术者。禁忌证包括:①巨型或大型垂体腺瘤向侧方、额底生长,或肿瘤呈哑铃形者;②垂体腺瘤向鞍上扩展,影像学提示肿瘤质地坚硬者;③蝶窦气化不良者;④鼻腔及鼻旁窦有炎症者。
分泌性垂体腺瘤经蝶窦入路手术切除肿瘤的疗效与肿瘤体积大小、有无周边浸润、术前激素水平高低、肿瘤能否全切、正常垂体保留程度以及首次或再次手术等因素有关。其中彻底切除肿瘤最为重要。一般如肿瘤为微腺瘤,无周边侵犯,激素水平轻至中度升高,肿瘤全切除,保留正常垂体及第一次手术者疗效较好。而影响肿瘤全切的因素有:①肿瘤发展阶段及大小,在肿瘤的初期,微腺瘤位于前叶内呈小结节形时为作选择性全切除的最佳时机。若肿瘤向鞍上、鞍旁、蝶窦内生长,体积较大者则不易完全切除。②肿瘤质地,95%的垂体肿瘤质地软,易于吸除,能达到全切程度。约5%肿瘤质硬,难以全切。术前长期服用溴隐亭者,有部分病例的肿瘤可纤维化,质硬不易全切。③肿瘤侵蚀硬膜,肿瘤体积愈大,愈易侵蚀硬膜,以分泌性腺瘤较多见,故不易全切。从以上因素中,可见早期诊断是争取作选择性全切除的先决条件。
3.药物治疗药物治疗的目的是试图减少分泌性肿瘤过高的激素水平,改善临床症状及缩小肿瘤体积。虽然当今尚无一种药物能治愈该类垂体腺瘤,但有些药物在临床实践中确实取得了较好的疗效。对无分泌性腺瘤,主要是针对垂体功能低下的症状选用肾上腺皮质激素、甲状腺激素及性腺激素予以替代治疗。
(1)PRL腺瘤:治疗PRL瘤的药物效果最为突出,其中主要有溴隐亭、喹高利特(Norprolac)及培高利特。
①溴隐亭:该药是一种部分合成的麦角生物碱溴化物,为多巴胺促效剂,可兴奋下丘脑,阻止PRL释放,或刺激多巴胺受体有效抑制PRL分泌,并能部分抑制GH浓度。对女性患者,服药后2周溢乳可改善,服药约2个月后月经可恢复,并且90%停经前妇女可恢复排卵及受孕。在男性病人,服药后数周性功能恢复,3个月后血睾酮浓度增加,1年内恢复正常,精子数亦可恢复。而对大腺瘤者,常可降低PRL水平,并且可使60%的肿瘤缩小,使病人头痛减轻、视野改善。但溴隐亭的缺点为停药后肿瘤又复增大,PRL再度升高,症状复发。另外,该药每天需服2~3次,有恶心、呕吐、乏力、直立性低血压等不良反应。还可导致服药后肿瘤发生纤维化,造成手术成功率(44%)较未服药者的(81%)显著降低。溴隐亭适用于:A.PRL微腺瘤者;B.PRL大腺瘤病人不愿手术或不适于手术者;C.手术和(或)放疗后无效者;D.大型PRL瘤向鞍外生长,可先服药3个月,如肿瘤明显缩小,则为手术创造条件;E.妊娠期肿瘤长大者;F.GH瘤和混合性肿瘤(GH-PRL,TSH-PRL),但仅部分病人有效。
②喹高利特:商品名“诺果亭”,是一种新型非麦角类长效多巴胺D2受体选择性激动药,对PRL的抑制作用是溴隐亭的35倍,消化道不良反应少。药物半衰期为11~12h,故多数患者每天仅需服药1次。
③培高利特:系国产麦角衍生物,亦是多巴胺激动药,能作用于PRL细胞膜内多巴胺受体抑制PRL合成与分泌。国内协作组临床治疗高PRL血症90例,疗效观察有效率为98.9%,其中PRL降至正常88例(97.8%),溢乳消失94.6%,月经恢复84.8%,妊娠21.1%,肿瘤缩小及消失47%,疗效略逊于溴隐亭治疗的对照组。但不良反应(同溴隐亭)仅有22.2%,低于溴隐亭治疗组的35.6%,且症状轻微,不需停药,2~4周内自然消失。治疗采用口服25~50μg/d,每2周调整1次,极量为150μg/d。
(2)GH腺瘤:药物治疗GH腺瘤主要依靠奥曲肽,其他有溴隐亭、赛庚啶等。
①奥曲肽:是生长抑素的衍生物,能较特异地抑制GH,且较生长抑素有更强的生物活性(抑制GH的活性比生长抑素高102倍)。该药皮下注射后血浆半衰期为120min,使GH浓度明显下降,故可用于治疗GH腺瘤。经观察,该药治疗后可使2/3以上的肢端肥大症患者的GH水平降至正常,20%~50%的患者肿瘤缩小,同时对TSH分泌腺瘤和促性腺素瘤亦有治疗作用。该药不良反应较小,包括局部注射疼痛、腹部痉挛性痛、胆石症和暂时性脂肪性腹泻及对GH瘤者的糖代谢呈双重影响。但由于此药需每天2~3次皮下注射,病人常难以长期坚持。
②BIM23014(BIM-LA):是一种新长效型(缓慢释放)生长抑素类似物,可避免重复注射或持续给药的不便,每2周注射1次。
③溴隐亭:对肢端肥大者亦有治疗作用,有报道治疗后GH水平降低者占2/3,但降至正常者仅20%,且治疗剂量较高PRL血症者明显为大,每天用量常达15~50mg。
④其他药物:赛庚啶可直接抑制GH分泌,有一定疗效。雌二醇作用于周围靶组织对GH起拮抗作用,使症状减轻。另有醋酸甲地孕酮(甲地孕酮)、氯丙嗪、左旋多巴等。
(3)ACTH腺瘤:许多药物已被用于治疗库欣病,包括5-羟色胺拮抗药赛庚啶、利他赛宁、多巴胺激动药溴隐亭和肾上腺功能抑制剂或毒性剂如酮康唑、米托坦(密妥坦)、美替拉酮(甲吡酮)、氨鲁米特(氨基导眠能)等。
①赛庚啶:可抑制血清素刺激CRH释放,使ACTH水平降低。每天剂量24mg,分3~4次给予,疗程3~6个月,缓解率可达40%~60%,对纳尔逊综合征也有效,但停药后症状复发。适用于重病人的术前准备及术后皮质醇仍增高者。
②利他赛宁:新型长效5-羟色胺拮抗药,每天10~15mg,连服1个月左右,效果较好且无明显不良反应,但停药后症状往往复发。
③酮康唑:作为临床应用的抗真菌药,能通过抑制肾上腺细胞色素P-450所依赖的线粒体酶而阻滞类固醇合成,并能减弱皮质醇对ACTH的反应。每天剂量400~800mg,分3次服用,疗程数周到半年,较严重的不良反应是肝脏损害。
4.放射治疗在垂体腺瘤的治疗中,放射治疗或可作为手术治疗或药物治疗的辅助疗法,也可作为一种确定的治疗方法。它可分为外放疗和内放疗两种。外放疗常用有超高压照射的60Co和直线加速器,重粒子放疗(α粒子、质子、中子等)以及γ-刀、X-刀等。内放疗有放射性核素(198Au、90Y等),与药物治疗的情况相同,放疗的有效性因垂体腺瘤的不同类型而有所不同。
(1)超高压照射(60Co、直线加速器):穿透性能较强,对皮肤、颅骨及正常组织影响较小。目前国内应用最多,已取代常规X线治疗。常用总剂量为45~55Gy,每周5次,每次180~200Gy。
①无分泌功能腺瘤:多为大腺瘤,早期单纯手术后的复发率为55%~67%,晚期肿瘤全切除后的复发率在12%~21%,复发多发生在术后4~8年。国外有报道即使肿瘤肉眼全切除,仍可有镜下残留的病变,如88%和94%的鞍内或向鞍上扩展的大腺瘤有硬膜的侵犯。故为防止肿瘤复发,提高手术治疗的效果,一般主张术后放疗。但近来也有研究者认为肿瘤全切除者,可临床密切观察,定期随访影像学,一旦肿瘤复发才予放疗,以免放疗引起的并发症。无分泌腺瘤对放射线治疗中度敏感,疗效较有分泌功能腺瘤为好。放疗后可使大部分肿瘤组织被破坏、体积缩小,所剩瘤组织增殖力明显减退,复发延缓。
放疗适应证:A.手术未全切除者。B.术后肿瘤复发且肿瘤不大者。C.诊断肯定而临床症状不显著者。D.年老体弱,或有重要器官疾病等不能耐受手术者。
放疗效果:国外报道单纯放疗肿瘤控制率为71%,手术后放疗病人的控制率可达75%。也有许多报道手术加放疗10年的局部控制率可达85%~94%。肿瘤复发后放疗,10年的控制率为78%;首次手术后放疗10年控制率可达91%。放疗后约半数病人的视力、视野障碍可望有些恢复,但亦有在放疗过程中或治疗以后发生肿瘤出血或囊变而使症状反而加重。
②分泌性垂体腺瘤:放射治疗分泌性腺瘤的疗效,以内分泌亢进症状较轻及激素升高水平较低者为好。
A.PRL瘤经放疗后部分病例血清PRL浓度可以降低,肿瘤缩小,但PRL多不能降至正常水平,部分无效。相对于手术或溴隐亭治疗的效果,放疗效果不满意。
B.GH瘤对放疗比较敏感,30%~70%的病人放疗后GH水平可低于5μg/L,60%~80%的病人GH水平可低于10μg/L,治疗的最大效应在3~5年。
C.ACTH瘤的放疗效果在20%~50%。儿童患者疗效较好,可达80%,有效时间短于GH瘤患者的。对纳尔逊综合征,无论用于预防或治疗,均能减少发生率或控制疾病。
由于开展经蝶显微手术后治疗效果有了明显提高,现多主张治疗分泌性腺瘤(TSH及PRL微腺瘤除外)应首选手术治疗,对手术未能全切除肿瘤病例,术后辅以放射治疗,可以减少肿瘤复发率。对肉眼全切除肿瘤病例,术后是否常规放疗,有研究认为肿瘤与正常组织之间无明显界限,瘤细胞常侵入正常垂体组织中,主张术后应放疗,但目前多认为手术后达到治愈标准者不需作放疗,可定期随访。对术中有脑脊液漏者应延期放疗,以待修补处充分机化。
(2)重粒子放疗:国外应用回旋加速器开展的重粒子治疗有α粒子束、质子束、负π介子、快中子等。利用Bragg峰效应,在确切的靶区内(垂体腺)可获高能量释放,但在邻近组织内能量释放甚小,故可用较大剂量治疗,而不良反应或并发症并不增加。国外用质子束治疗431例肢端肥大症病人,在以后的4年中有80%病人获得控制(GH
ACTH腺瘤国外治愈率为74%~85%,其中库欣病病理证实有腺瘤者治愈率为87%~91%,未证实有腺瘤者为60%。国内协和医院中远期平均随访3年,病理证实有腺瘤或前叶细胞增生或无异常组的治愈率分别为63.1%、72.7%及48.1%,微腺瘤组肿瘤加瘤周腺垂体大部分切除的治愈率可达80%。上海瑞金医院Ⅰ级肿瘤根治率为85%,Ⅱ~Ⅲ级为60%。上海华山医院库欣病的治愈率为86%,纳尔逊综合征无1例治愈。儿童ACTH瘤的治愈率国外为80%~100%,国内为91%。
分泌性腺瘤术后长期随访的复发率:PRL瘤平均复发为17%,个别报道达40%;GH瘤为5%~12%,ACTH瘤2%~10.5%,个别为20.6%。国内资料PRL瘤复发率为5.26%(北京协和医大),GH瘤为3.6%(天津医大),ACTH瘤为11.4%(北京协和医大)。肿瘤复发原因大多与肿瘤切除不彻底而有残留组织,或为高增殖垂体腺瘤,或肿瘤向周边组织侵犯(侵袭性垂体腺瘤)有关。少数可因多发性微腺瘤或垂体细胞增生。
预防
垂体瘤康复护理预防
1、应选用含磷脂高的食物以健脑,如蛋黄,鱼,虾,核桃,花生等。
2、饮食要规律,不要暴饮暴食,按时吃饭。
3、脑垂体瘤患者要多吃富含维生素A,胡萝卜素以及维生素B2的食品。
4、宜清淡,少食辛辣,煎炒,油炸,烈酒等不消化和刺激性食物,多食水果,蔬菜和纤维性食物,多饮水。
5、要有意识地多食用保护眼睛的食物,如鸡蛋,动物的肝,肾,胡萝卜,菠菜,小米,大白菜,番茄,黄花菜,空心菜,枸杞。
-
相关疾病
高血压 心律失常 动脉粥样硬化 癫痫 头痛 脑出血 失眠 脑血管病 脑膜炎 偏瘫 三叉神经痛 失语症 腹泻 糖尿病 甲亢 甲状腺炎 垂体瘤 内分泌失调 骨质疏松 尿崩症 发育迟缓 库欣综合征 性早熟 低血糖症 高泌乳素血症 肢端肥大症 巨人症 低钠血症 风湿性关节炎 肺癌 肺栓塞 肾功能衰竭 水中毒 胶质瘤 脑膜瘤 脑积水 颅咽管瘤 蛛网膜下腔出血 脊索瘤 脑脊液鼻漏 颅内血肿 颅内压增高 肾上腺肿瘤 性功能障碍 男性病 动脉瘤 外阴瘙痒 闭经 流产 脊髓压迫症 骨质增生 腕管综合征 视神经萎缩 失明 鼻窦炎 鼻出血 放疗 阳痿 痤疮 疼痛 霍乱 休克 胆石症